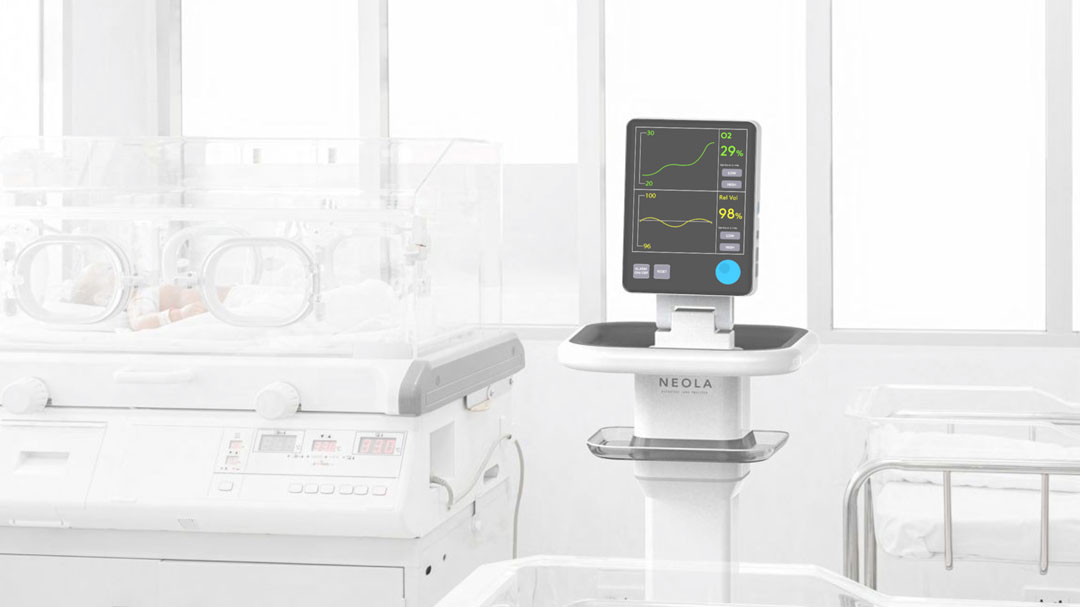
Neola Medical AB (publ) meddelar att bolaget har lämnat in en så kallad pre-submission till det amerikanska läkemedelsverket Food and Drug Administration (FDA) för NEOLA®.
Neola Medical förväntar sig ett första möte med FDA under höstens början för att få återkoppling på bolagets regulatoriska plan. Därefter kommer bolaget att ha en bra förståelse för processen för ett FDA-tillstånd för NEOLA®, Neonatal Lung Analyzer, som ger kontinuerlig övervakning av för tidigt födda barns lungor för att omedelbart upptäcka andningsrelaterade komplikationer.
”Den amerikanska marknaden är den viktigaste för vår del och därför är inlämningen av pre-submission till FDA ett viktigt steg i vår resa mot tillstånd för NEOLA® på den marknaden. Vi samarbetar med en amerikansk FDA-konsult som har erfarenhet av just medicinteknik för barn som är födda för tidigt, vilket vi ser är en fördel. Återkopplingen från FDA kommer att ge oss en bra bild av den kommande regulatoriska processen framåt samt de studier vi behöver genomföra. För varje steg vi tar, kommer vi närmre vår vision om att NEOLA® ska hjälpa för tidigt födda barn att få en bättre start i livet”, säger Hanna Sjöström, vd för Neola Medical.
Läs pressmeddelandet i sin helhet här: Pressmeddelande